

开头语
最近关于“人民的希望”瑞德西韦(Remdesivir)的两条好消息又引发了医药人们的热捧。
消息一:2月15日下午,国务院应对新型冠状病毒感染肺炎疫情联防联控机制在北京召开新闻发布会,介绍药物研发和科研攻关最新进展情况。瑞德西韦在在武武汉十余家医疗机构Ⅲ期临床试验如期开展,已入组重症患者168例,轻型、普通型患者17例。
消息二: 2月14日晚,海南海药发布公告称,已经完成瑞德西韦原料药及制剂工艺研发。原料药纯度在99%以上,制剂中试生产已完成,可批量生产瑞德西韦50mg、100mg两种剂型,已具备瑞德西韦制剂年产350万支的能力。这是继2月12日苏州博瑞制药公布已经批量生产出瑞德西韦原料药之后,第二家公开有生产能力的企业。更好的消息是海南海药已将制剂工艺打通。
瑞德西韦似乎目前成了这场疫情最为瞩目的明星,如果Ⅲ期临床试验成功,这对中国及世界人民抗击COVID-19来说都是振奋人心的消息。那么瑞德西韦如何走上临床Ⅲ期?在临床试验中将经历什么?临床试验结果的影响又将怎样?本期我们重点聊聊与瑞德西韦临床试验相关的那些事儿。
临床前的筛选 - 众星捧月的瑞德西韦
瑞德西韦为什么能在这次疫情中“横空出世”,马上投入临床试验?这个药并不是在疫情发生后迅速研发出的新药,众多周知,新药筛选没有那么容易和高效。
瑞德西韦是一家名叫吉利德科学(Gilead Sciences)的公司最早研发用于抗击埃博拉病毒的药物,其作用机理是抑制RNA聚合酶,即干扰病毒把遗传物质信息复制在人类DNA上。虽然埃博拉病毒是一种丝状病毒,新型冠状病毒是一种冠状病毒,外形上有很大的差异。但病毒进入细胞后他们必须要以自身为模板释放RNA聚合酶,在RNA聚合酶的作用下,病毒将自己的遗传信息保存在人类DNA上,从而实现感染宿主的过程。因此这是一种广谱抗病毒药物。
瑞德西韦分别在2016年9月(Ⅱ期临床实验NCT02818582)及2018年12月(Ⅱ&Ⅲ期临床实验,NCT03719586)进行了两次关于治疗埃博拉病毒的临床研究,但两次均以失败收场。
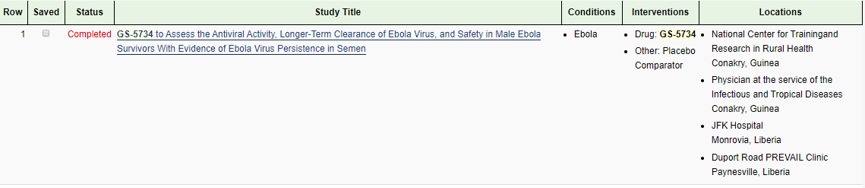

瑞德西韦用于治疗埃博拉病毒的两次临床试验
*以上图片来源于clinicaltrials.gov
后来,科学研究也证明,在前期的细胞和动物实验中,瑞德西韦均显示出对SARS冠状病毒、MERS冠状病毒有较好的抗病毒活性。本次的新型冠状病毒也属冠状病毒,因此初判这种广谱抗病毒药应对本次疫情有疗效。
自疫情爆发之后,中国科学院武汉病毒研究所等科学家研究发现在Vero E6细胞上,瑞德西韦(Remdesivir, GS-5734)在细胞水平上能有效抑制新型冠状病毒的感染,但在人体上的作用还有待临床药物。为此武汉病毒所很快抢注了瑞德西韦在治疗新型冠状病毒肺炎方面有使用专利。
1月31日,一篇文章介绍了美国首例确诊COVID-19病例在住院7天之后开始使用药物瑞德西韦(同情给药),体温从当天天的39.4℃降低到次日的37.3℃,且症状明显减轻。后据CNN报道已经出院。这则消息无疑让人民对瑞德西韦有了更多的期待。

美国首例COVID-19
*以上图片来源于The New England Journal of Medicine
鉴于以上抗病毒原理研究、体外试验,一例治愈案例等种种良好的数据表现,大家对瑞德西韦给与了更多的关注和希望。但在人体应用前仍需严谨的临床试验评价。
临床试验之前 - 全村的希望
要真正走向临床实验,有许多前奏工作需要开展。谁来牵头开展临床实验?选择哪些医院作为临床试点?谁来提供临床样品?如何设计合理的临床实验方案?临床实验如何快速审批走向临床对象招募?
最后由中日友好医院、中国医学科学院药物研究所牵头开展临床实验,选择武汉金银潭医院等武汉疫区作为临床试点,本次临床试验样品由吉利德公司免费提供。采用随机、双盲、安慰剂对照方法展开。在科技部、国家卫健委、国家药监局等多部门支持下,瑞德西韦已完成两个临床试验的注册审批工作。经过层层努力,首批新冠肺炎的重症患者6日已接受用药。
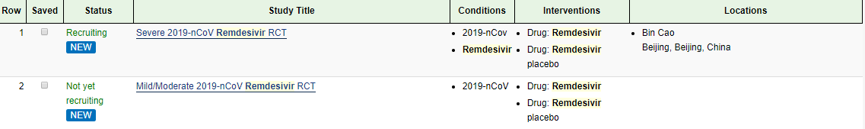
瑞德西韦用于治疗COVID-19的两次临床试验
*以上图片来源于clinicaltrials.gov
临床试验之中 - 未来3个月在酝酿
// 临床试验简介
首先简单说明一下药物临床试验的阶段及目的。临床试验一般分临床前试验、I-IV期临床试验。
临床前试验是在动物中进行的试验,研究药效学与急性毒性试验结果,以及长期毒性试验结果,为进行人体临床试验提供依据,如人体初试剂量、可能的不良反应等。
I期临床试验:在健康志愿者(通常8-20名)身上进行,观察人体对于新药的耐受程度和药物代谢过程,目的是确定可用于临床的安全有效剂量与合理给药方案。
II期临床试验: 在小范围患者(100-200例)体内进行,是治疗作用的初步评价阶段。 对疗效、适应症、不良反应进行详细考察,初步评价试验药物对目标适应症患者的治疗作用和安全性; 为III期临床试验研究设计和给药剂量方案的确定提供依据。
III期临床试验:大范围患者(>300例),在全国或国际范围内进行,为治疗作用确证阶段,进一步验证药物对目标适应症患者的治疗作用和安全性,评价利益与风险关系,最终为药物注册申请的审查提供充分的依据。
IV期临床试验: 受试者>2000例,为新药上市后应用研究阶段。考察在广泛使用条件下的药物的疗效和不良反应,着重于新药的不良反应监察与扩大药物治疗的适应症范围。
// 本次临床试验如何开展?
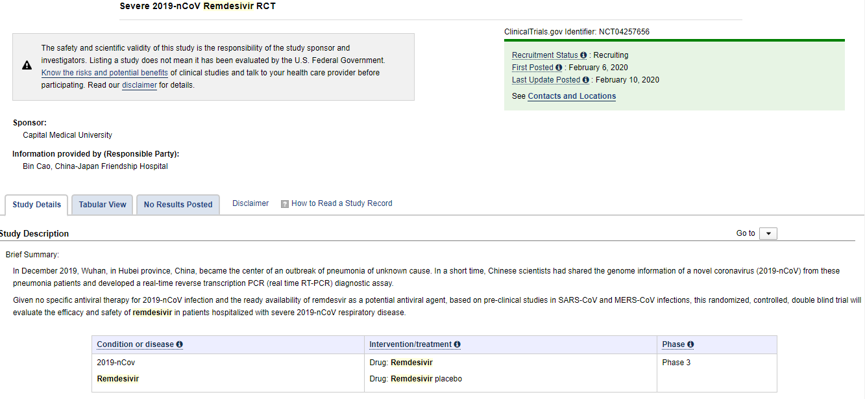
瑞德西韦用于治疗COVID-19重症患者临床试验
*图片来源于clinicaltrials.gov
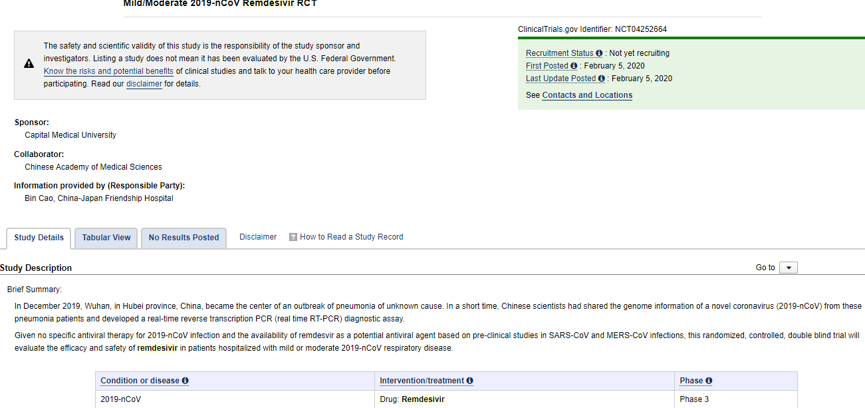
瑞德西韦用于治疗COVID-19轻/中度症患者临床试验
*图片源于clinicaltrials.gov
// 本次临床实验的原则是什么?
本次采取随机,双盲,安慰剂对照法。
// 两个实验分别入组多少人?
分为两个临床试验来开展。入组轻/中症患者308例,重症患者452例,总计拟入组760例患者,另据报道2/3的患者是瑞德西韦给药,1/3的患者是安慰剂给药。入组人数要符合统计学意义。
// 两组如何给药?
以轻/中度实验为例,将分成两个组:试验组及对照组。实验组中患者给予瑞德西韦治疗(第一天静脉滴注200mg瑞德西韦,第2~9天静脉滴注100mg瑞德西韦),对照组中给予安慰剂治疗(第一天静脉滴注200mg安慰剂,第2~9天静脉滴注100mg安慰剂)。但两个分组中的患者都接受背景支持治疗,所以不要担心对照组,他们那也是会给予相关的支持治疗。2月6日,首位受药的是一位68岁的男性重症患者。但不知道他接受的是瑞德西韦还是安慰剂。
// 本次实验的设盲方式是什么?
本次采用四重盲法。即受试者、医护人员、研究者及疗效评估者都不知道病人使用的是瑞德西韦还是安慰剂。四重盲法的试验能够最大程度地保证实验的有效性和结论的正确性。
// 临床试验的主要终点是什么?
轻/中度临床试验:临床恢复时间最多为28天。临床恢复时间指从试验治疗开始,无论患者使用瑞德西韦还是安慰剂,至患者体温、呼吸频率、血氧饱和度和咳嗽出现缓解症状的时间。缓解维持一定要达到72小时,才被认为是真正的恢复时间。
重度临床试验:临床缓解时间最多为28天。临床缓解时间指从试验治疗开始,无论患者使用瑞德西韦还是安慰剂,至患者临床状态缓解两个等级所需的时间。但需要注意,缓解程度达两个级别且维持一定要72小时。
// 临床试验到什么时候结束?
轻/中度临床试验计划于4月27日结束,重度临床试验将于5月1日结束。由于试验设盲,所以医生、患者都不知道用的是安慰剂还是药品,只有揭盲的时候,才知道结果。
临床试验之后 - 4月27日的结果
结果一:临床试验成功,实验组显示了对新冠病毒明显的抑制作用。这对大家来说都是欢欣鼓舞的。但后面的问题将接踵而至,是否可以投入生产?武汉病毒所的使用专利是否可以顺利批准? 原研厂家还没有上市,专利保护期还没有结束中国已经研发出合成工艺及制剂工艺的企业是否可以生产(苏州博瑞制药及海南海药)?吉利德对于这个药品的使用权利开放在中国有多大?希望这些问题都可以通过法律和磋商得到友好解决的。
结果二:临床试验失败,实验组对冠状病毒没有明显的抑制作用或其他副作用显著。那对大家来说都是一个非常遗憾的结局。后续只能将人民的希望投向其它的药品上或者继续研发。
同期的临床试验 - 其它星星之火
星星之火,可以燎原。面对疫情,不可能将所有的希望寄希望于瑞德西韦,医药工作者也从众多药物中进行了筛选和研究。查询中国临床试验注册中心,截止2月16日11:25,可以看到目前我国已经有 129项关于攻克COID-19的药物和治疗方法在临床试验中。纵观这些临床试验,有中医,有西医,还有中西医结合的治疗方法;有干细胞,有激素,有化合物治疗;临床研究或者已经得到审批,或在批准中,或已经进入招募试验阶段。希望这些研究中的几个或一个能够“杀出重围”,为战胜疫情增添“一抹亮丽的彩色”。

新型冠状病毒临床研究索引摘选
*数据来自中国临床试验注册中心网站
结语
这3个月的临床试验就像是怀孕,谁都不知道结果是什么,但却万众瞩目。全国病患和人民群众都在热切期盼这个结果。这个结果很大程度影响了后续国家的应对政策,也直接影响到每个人的生活方式。愿4月27日再次听到瑞德西韦的好消息传来。
// 新加坡国立大学 张博士
本文作者独家供稿
相关专题

