

Contributors: Erick M. Carreira, Michael A. Imhof
Que Y, Shao H, He H, Gao S. * East China Normal University, Shanghai, P.R. of China
Total Synthesis of Farnesin via an Excited-State Nazarov Reaction
Angew. Chem. Int. Ed. 2020;
DOI: 10.1002/anie.202001350.
本文由武汉大学张旌扬推荐解读。
原文解读
对映-贝壳杉烯二萜(ent-Kaurenoids)是一类具有复杂的化学结构以及独特的生物活性的天然产物,而受到合成化学家的关注。Farnesin是一种具有syn-syn-syn三顺式氢化芴型骨架的对映-贝壳杉烯二萜类化合物,这一高张力结构使得farnesin及相关化合物的合成困难重重。
纳扎罗夫环化反应(Nazarov Cyclization)是十分有用的五元碳环骨架构建策略,底物在反应条件(多为路易斯酸或光照)下发生4π电环化反应成环,随后脱去一个质子得到产物,反应的立体选择性符合伍德沃德-霍夫曼规则。在进行了模板体系的研究之后,作者基于纳扎罗夫环化反应,设计了如下的合成路线(图 1):基于纳扎罗夫环化,farnesin可被逆推至化合物2,再从羰基处切断,逆推至化合物3、化合物4。
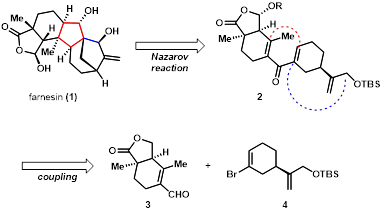
图 1 farnesin的逆合成分析
在farnesin的合成(图 2)中,作者首先从化合物5、化合物6出发,基于辅基策略合成了片段3和4,之后通过卤锂交换以及亲核加成-氧化合成了分子9。
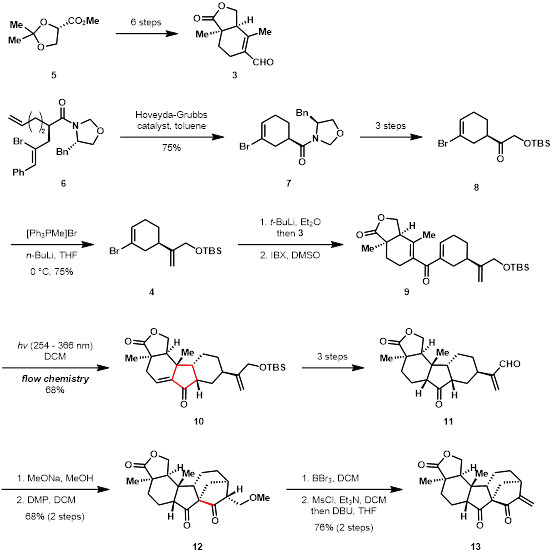
图 2 中间体分子13的合成
之后,9在光照下发生激发态的纳扎罗夫环化反应得到核心结构10,后经脱保护以及氧化态调整合成分子11。分子11在碱的作用下发生分子内羟醛缩合,之后氧化生成的醇,并脱除甲氧基得到中间体分子13。
在得到分子13后,作者开始进行氧化还原等后续结构调整(图 3)。作者发现,简单的硼氢化钠还原无法生成具有所需构型的手性中心(13到14)。随后,作者调整策略,通过米尔温-庞多夫-韦尔莱还原反应(Meerwein–Ponndorf–Verley Reduction)进行还原,得到了一个所需的手性中心和一个与目标具有相反构型的手性中心。
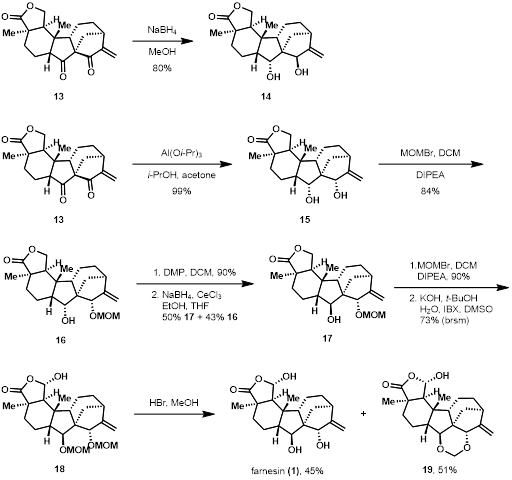
图 3 Farnesin的合成
面对这一问题,作者计划通过位阻效应影响还原的立体选择性。首先对正确的手性中心进行MOM保护,利用MOM的位阻效应,将构型相反的手性中心氧化消旋后再还原后得到了所需的手性中心。最后氧化引入羟基并脱保护,完成了farnesin的全合成。
总结与评述
这一工作报道了基于纳扎罗夫反应的farnesin的首次不对称合成。路线设计简洁而汇聚,既显示出作者深厚的功力,又展现出纳扎罗夫环化反应在合成多环化合物方面的巨大潜力。除去纳扎罗夫反应外,这一合成中对于流动化学技术(flow chemistry)的应用以及合成后修饰中的立体结构调整同样十分精彩,值得一看。
这一工作的提升空间或许在于环化前体的合成路线设计以及合成最后阶段的立体结构调整。利用手性池(chiral pool)以及化学酶法合成(chemoenzymatic synthesis)策略或许是一种潜在的改进思路;而通过设计具有特定结构的还原剂也许可以实现一步立体选择性的还原,以免去繁琐的立体结构调整。
参考文献
Carreira, E. M.; Imhof, M. A., Synthesis of (–)-Farnesin. Synfacts 2020, 16 (05), 0498.
Que, Y.; Shao, H.; He, H.; Gao, S., Total Synthesis of Farnesin through an Excited-State Nazarov Reaction. Angewandte Chemie International Edition 2020, 59 (19), 7444-7449.
SYNFACTS
阅读SYNFACTS更多论文,请点击: https://www.thieme-connect.com/products/ejournals/journal/10.1055/s-00000131
